
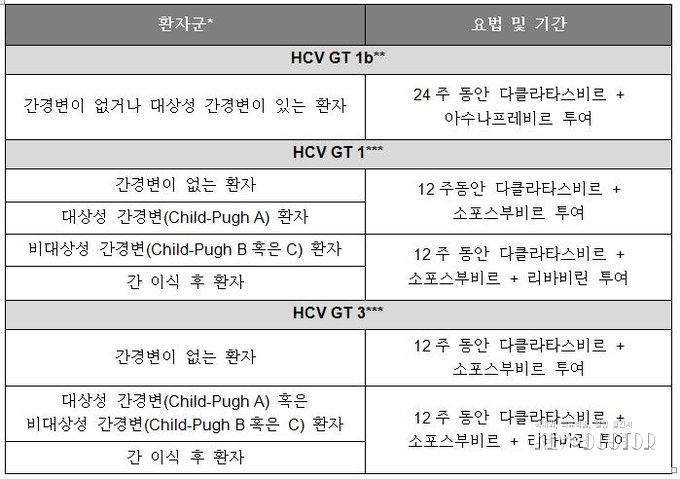
**이 약과 아수나프레비르의 병용요법에서 치료경험이 없거나 다른 HCV 프로테아제 저해제 치료경험이 없고 이전에 페그인터페론-α 및 리바비린의 치료에 실패한 환자
***이 약과 소포스부비르(리바비린 병용과 상관 없이)의 병용요법에서 치료경험이 없거나 페그인터페론-α 및 리바비린 또는 HCV 프로테아제 저해제 치료에 실패한 환자
[참고 자료]
AI444040 임상시험2
AI144040 임상시험에서는 연구 시작 당시 44명의 이전 치료 경험이 없는 유전자형 1형 C형간염환자와 44명의 유전자형 2형 또는 3형 C형간염환자에게 1일 1회 다클린자 60mg과 1일 1회 소포스부비르 400mg을 리바비린과 함께 또는 리바비린 없이 24주간 투약하도록 무작위 배정했다. 추후 연구가 확대되어, 유전자형 1형 환자 123명을 추가로 포함했으며, 추가로 등록된 환자들에게는 다클린자-소포스부비르를 리바비린과 함께 또는 리바비린 없이 12주 (이전 치료 받은 경험 있는 환자 82명) 또는 24주(이전에 텔라프레비르 또는 보세프레비르와 페그인터페론 알파-리바비린 요법으로 바이러스 반응에 실패한 환자 41명) 투약하도록 무작위로 배정했다. 일차 평가변수는 치료 종료 후 12주 시점에서 지속바이러스반응률(HCV RNA 수치 25IU/ml 미만)였다. 전체적으로 211명의 환자가 치료를 받았다. 다클린자-소포스부비르 병용요법(리바비린과 함께 또는 리바비린 없이)은 이전 치료 경험이 없는 유전자형 1형 환자의 98%의 SVR12, HCV 프로테아제 억제제로 지속바이러스반응을 보이지 않았던 환자에서 98%의 SVR12, 유전자형 3형 감염 환자의 89%에서 SVR12를 보였다. 가장 흔한 이상반응은 피로, 두통, 구역이었다. 또한, 유전자형 1a형과 1b형 환자(각각 98%와 100%)와 유전자형 CC 또는 비CC IL28B형 환자(93%, 98%)에서 높은 SVR12가 관찰됐으며, 리바비린을 투여한 환자와 투여하지 않은 환자(각각 94%와 98%)에서도 마찬가지로 높은 SVR12이 보고됐다. 가장 흔한 이상반응은 피로, 두통, 구역이었다.
ALLY-3 (AI444218) 임상시험3
ALLY-3임상시험에서는 유전자형 3형 환자 152명을 대상으로 12주 기간 다클린자-소포스부비르 병용요법의 효능과 안전성을 평가했다. 이전에 치료 경험이 없는 101명의 환자와 이전에 치료 경험이 있는 51명의 환자들은 1일 1회 다클린자-소포스부비르 400mg를 12주 동안 투여했다. 공동 일차 평가변수는 치료 경험이 없는 환자군과 치료 경험이 있는 환자군에서 치료 종료 후 12주 시점에서 지속바이러스반응률(SVR12)을 달성한 환자의 비율이었다. SVR12 비율은 치료 경험이 없는 환자들의 90%(91/101), 치료 경험이 있는 환자들에서 86%(44/51)였으며, 바이러스 돌파는 관찰되지 않았다. 환자의 99% 이상이 치료 종료 시점에서 바이러스반응을 보였다. SVR12 비율은 간경변증이 있는 환자(63% [20/32])보다 간경변증이 없는 환자(96% [105/109])에서 더 높게 나타났다. 이전에 소포스부비르 포함 요법의 치료에 실패했던 7명 환자 중 5명과 이전에 알리스포리비르 포함 요법의 치료에 실패했던 2명 환자 중 2명이 SVR12를 달성했다. 성별, 연령, HCV RNA 수치, 유전자형 IL28B형 같은 기저선 특징은 바이러스 결과에 영향을 미치지 않았다. 다클린자-소포스부비르 병용요법의 내약성은 양호했으며, 이상반응으로 인해 약물을 중단한 환자는 없었다. 1명의 환자에서 치료 중 심각한 이상반응이 발견됐지만, 연구 약물과는 관련이 없었다.
ALLY-2 (AI444216) 임상시험4
ALLY-2 임상시험에서는 HCV/HIV-1 동반감염환자를 대상으로 이전에 치료 경험이 없는 환자 151명과 이전에 치료 경험이 있는 환자 52명에게 다클린자-소포스부비르 병용요법을 12주간 투여했다. 이전에 치료 받은 경험이 없는 환자들은 1일 1회 다클린자 60mg 과 소포스부비르 400mg로 12주 또는 8주 치료 받도록 2:1 비율로 무작위 배정됐다. 이전에 치료 받은 경험이 있는 환자들도 동일한 용량으로 12주 동안 치료 받도록 배정됐다. 일차 평가변수는 이전에 치료 받은 경험이 없는 C형 간염 바이러스 유전자형 1형 환자들의 치료 종료 후 12주 시점에서의 지속바이러스반응률(SVR12)이었다. 등록된 유전자 1-4형 C형간염 환자 중 83%가 유전자형 1형이었다: 14%는 대상성 간경변증을 앓고 있었고, 98%는 항레트로바이러스 치료를 받고 있었다. 유전자형 1형 환자의 경우, 지속바이러스반응(SVR)은 이전에 치료 받은 경험이 없는 환자들 중에서는 12주 동안 치료 받은 환자의 96.4% (95% 신뢰구간[CI], 89.8-99.2), 8주 동안 치료 받은 환자의 75.6% (95% CI: 59.7-87.6)로 보고됐다. 또한, 이전에 치료 받은 경험이 있는 환자들 중에서 12주 동안 치료 받은 환자의 97.7(95% CI: 88.0-99.9)가 SVR12 를 획득했다. 모든 유전자형에 걸쳐 지속바이러스반응률은 각각 97.0%(95% CI: 91.6-99.4), 76.0%(95% CI: 61.8-86.0), 98.1%(95% CI: 89.7-100)였다. 가장 흔한 이상반응은 피로, 구역, 두통이었다. 이상반응 때문에 연구 약물을 중단한 환자는 없었다. HIV-1 억제 효과에 영향이 미치지 않았다.
ALLY-1 (AI44215) 임상시험5
ALLY-1 임상시험에서는 대상성/비대상성 간경변 또는 이식 후 재발을 동반한 모든 유전자형의 C형 간염 환자로 구성된 두 개의 환자군을 대상으로, 12주 간의 약물 투여 및 24주간의 추적 관찰을 통해 1일 1회 다클린자 60mg과 1일 1회 소포스부비르 400mg 및 1일1회 600mg 리바비린과 병용 투여 시의 안정성과 효능을 평가 했다. 이 연구에는 60명의 진행성 간경변 환자와 53명의 이식 후 재발 환자가 등록됐다: C형 간염 바이러스 유전자형 1(76%), 2, 3, 4, 6형이 확인됐으며, 간경변증 환자들에서 Child-Pugh 분류는 20% A, 53% B, 27% C였다, 일차 효능평가는 각각의 환자군(co-hort)의 유전자형 1형 감염 환자의 치료 후 12주 시점에서의 지속바이러스반응률(SVR12 )이었다. 연구 결과, 간경변증 환자에서 유전자형 1형 감염 환자의 82% (95% 신뢰구간[CI], 67.9%-92.0%)가 SVR12 를 달성한 반면에, 유전자형 2, 3, 4형에서 반응률은 각각 80%, 83%, 100%였다. SVR12 비율은 Child-Pugh A 또는 B로 분류된 환자에서 더 높아 93%였으며, C로 분류된 환자에서는 56%였다. 이식을 받은 환자에서 SVR12는 유전자형 1형과 3형 감염 환자에서 각각 95%(95% CI: 83.5%-99.4%)와 91%였다. 3명의 환자가 최소한의 투여 일시 중지로 인해 이식 주위 치료를 받았으며, SVR12 를 달성했다. 치료 관련 심각한 이상반응은 없었다.
C형간염 분야에서 BMS
BMS는 전 세계 난치성 C형간염 환자의 치료와 C형간염 해결책이 부족한 국가의 C형간염 환자 치료에 중점을 두고, C형간염을 근절하는 데 매진하고 있다. 2014년 7월 일본은 세계 최초로 다클라타스비르 기반 요법을 만성 C형간염 치료제로 승인했다. 이후 다클라타스비르 기반 요법은 유럽, 중남미, 중동, 아태 지역의 50개 이상 국가에서 승인됐다.
- 국내(대한민국) 현황
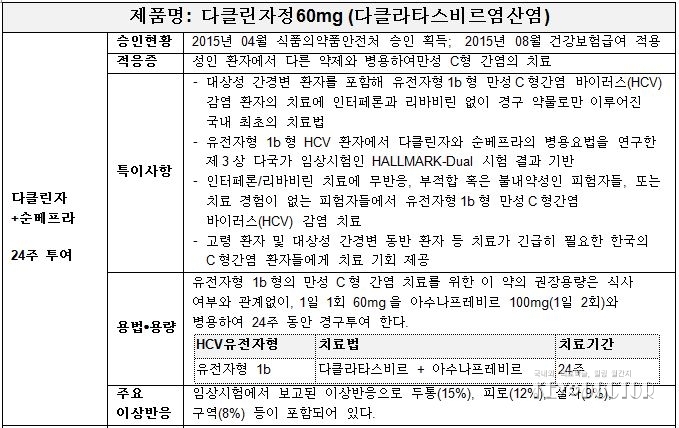
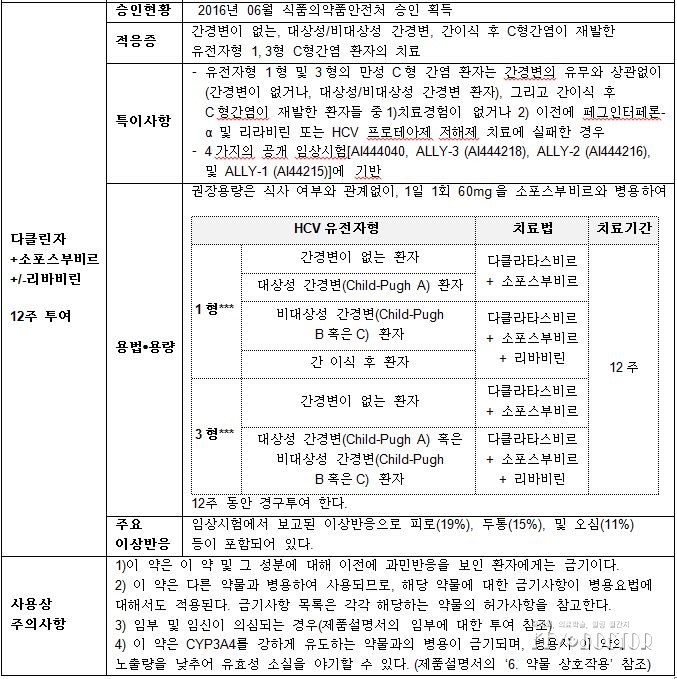
1. 20160202 의약품목 허가사항 변경허가 [(유)한국비엠에스제약-다클린자정 60밀리그램(다클라타스비르 염산염)], 식품의약품안전평가원
2. Mark S. Sulkowski, M.D. et al. Daclatasvir plus Sofosbuvir for Previously Treated or Untreated Chronic HCV Infection. The New England Journal of Medicine Jan 2014; 211.
3. David R. Nelson et al. All-Oral 12-Week Treatment With Daclatasvir Plus Sofosbuvir in Patients With Hepatitis C
Virus Genotype 3 Infection: ALLY-3 Phase 3 Study. Hepatology May 2014; 4.
4. D.L. Wyles et al. Daclatasvir plus Sofosbuvir for HCV in Patients Coinfected with HIV-1. The New England Journal of Medicine 2015; 1.
5. Fred Poordad et al. Daclatasvir with Sofosbuvir and Ribavirin for Hepatitis C Virus Infection with Advanced Cirrhosis or Post-Liver Transplantation Recurrence. Hepatology 2016; 1.
6. 2015 대한간학회 C형간염 진료 가이드라인
7. Intervirology 2006; 49: 18-22
8. 2013 대한간학회 C형간염 진료 가이드라인
9. MCPhee F, et al. Adv Ther. 2015;32:637-649
10. Garimella T, et al. 15th International Workshop on Clinical Pharmacology of HIV& Hepatitis Therapy 2014. Poster P_43
Manns M, et al. Lancet 2014;384:1597–605
11. Garimella et al. AASLD 2013. Oral presentation 463

















